由结核分枝杆菌(Mtb)感染引起的结核病严重威胁着我国公共卫生安全。研究表明,巨噬细胞是宿主抵御Mtb感染最重要的免疫细胞之一,也是Mtb在体内的主要寄居地。Mtb通过破坏或抑制巨噬细胞的抗结核免疫保护功能以实现其免疫逃逸,从而在胞内存活、寄生,甚至进一步复制、扩大感染。近年来的研究发现,Mtb可能通过破坏或抑制巨噬细胞cGAS介导的抗菌免疫和自噬以实现免疫逃逸,国内同行和我们近期的研究均发现:通过二价锰离子(Mn2+)激活感染巨噬细胞中cGAS通路和自噬能有效抑制体外和体内Mtb感染。然而,二价锰离子(Mn2+)的性质极不稳定、易被氧化,且在体内易扩散、靶向性差,难以直接用于抗结核治疗。

近日,我校免疫与感染性疾病研究团队在Acta Biomaterialia(中科院一区,IF=9.4)报道了靶向结核感染巨噬细胞cGAS介导自噬通路的抗结核新策略,开发了一种巨噬细胞靶向的二氧化锰纳米材料(Tuf-Rif@HA-MnO2 NPs),不仅可以实现抗结核药物的巨噬细胞靶向递送,且进入巨噬细胞后能与胞内谷胱甘肽(GSH)反应,直接在感染巨噬细胞内释放二价锰离子(Mn2+)以激活其cGAS通路、及其介导的自噬,从而进一步增强巨噬细胞、DCs、T细胞的抗结核免疫保护功能。结果显示Tuf-Rif@HA-MnO2 NPs能结合靶向药物递送和cGAS-自噬介导的抗结核免疫保护功能,以更有效、协同地抑制Mtb感染、减轻结核病损,该策略有望用于开发更有效的结核病或耐药结核病宿主导向治疗新方案。
我校免疫与感染性疾病研究团队的副研究员廖康生博士、助理研究员陈锐洪博士、以及重庆市中医院的张金卫博士为本文的第一作者,我校免疫与感染性疾病研究团队的杨芬博士、徐军发教授、皮江博士、以及伊利诺伊大学医学院的Ling Shen教授为本文的共同通讯作者。该研究得到了国家自然科学基金(82272348, 82404964, 82270013, 82300016)等项目的大力支持。
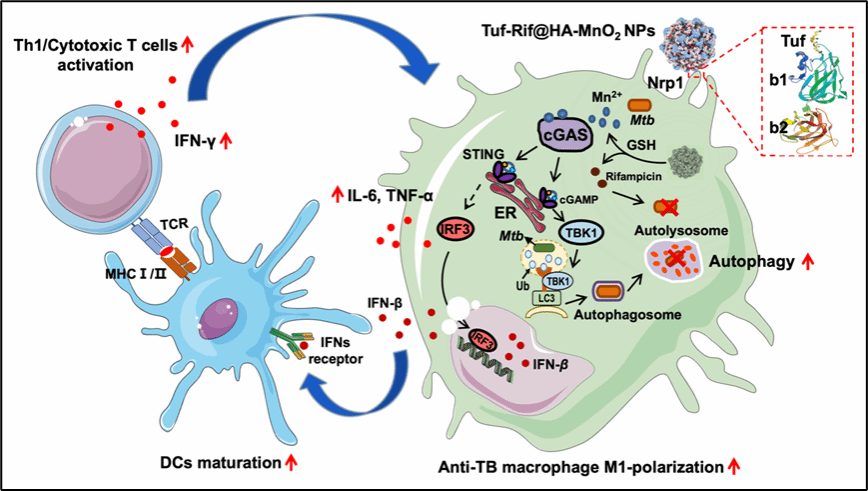
Tuf-Rif@HA-MnO2 NPs的抗结核作用机制示意图
文、图/廖康生
初审/杨芬
复审/皮江
审发/张华

