李璐博士在Oncogene发表论文报道抑制胃癌恶性发展新靶点
近期,广东医科大学医学技术学院李璐博士联合中山大学附属第一医院、中山大学附属第七医院在Oncogene (IF=8.756,中科院大类学科分类为I区)发表了题为“CPEB3 suppresses gastric cancer progression by inhibiting ADAR1-mediated RNA editing via localizing ADAR1 mRNA to P bodies”的研究论文,报道了胞浆聚腺苷酸化元件结合蛋白3(CPEB3)通过抑制ADAR1介导的RNA编辑进而抑制胃癌恶性进展的研究,揭示了其可作为胃癌治疗的潜在新靶点。
胃癌是世界范围内第五大常见恶性肿瘤,是第四大肿瘤相关死因。胃癌生物学行为高度恶性,即使在早期也易发生侵袭转移,导致胃癌患者总体生存率不容乐观。因此,阐明胃癌恶性进展的分子机制,鉴定出新的治疗靶点和预后标志物,对于改善胃癌患者预后具有重要意义。该研究中,作者发现CPEB3在胃癌细胞系和组织中均表达下调,其低表达与胃癌患者侵袭性临床病理特征及不良术后预后相关。体内和体外实验证实,过表达CPEB3能抑制胃癌细胞增殖和转移,且发现其通过ADAR1介导的RNA编辑受阻,从而抑制胃癌的恶性进展。进一步的研究结果表明,CPEB3与P小体的主要成分GW182可以直接结合并鉴定出具体的结合区域。该研究最后评估了应用AAV9-CPEB3靶向上调胃癌组织内CPEB3表达的治疗策略在胃癌基因治疗中的应用价值。结果发现AAV9-CPEB3可以显著抑制胃癌的生长和转移,对小鼠的肝脏造成肝细胞水样变性;但对小鼠的肾功能没有明显损伤。因此,破译RNA结合蛋白和相应的靶点RNA之间的交互关系,有助于更好地阐明胃癌生物学行为背后的调控机理,为阻断胃癌进展提供一种有应用前景的治疗方法。
中山大学附属第一医院陈键博士为本文第一作者,广东医科大学医学技术学院的李璐博士为本文共同第一作者,中山大学附属第一医院、中山大学附属第七医院杨东杰教授和何裕隆教授为该文的通讯作者。该研究得到国家自然科学基金(项目编号:81802599,81772579)的大力支持。
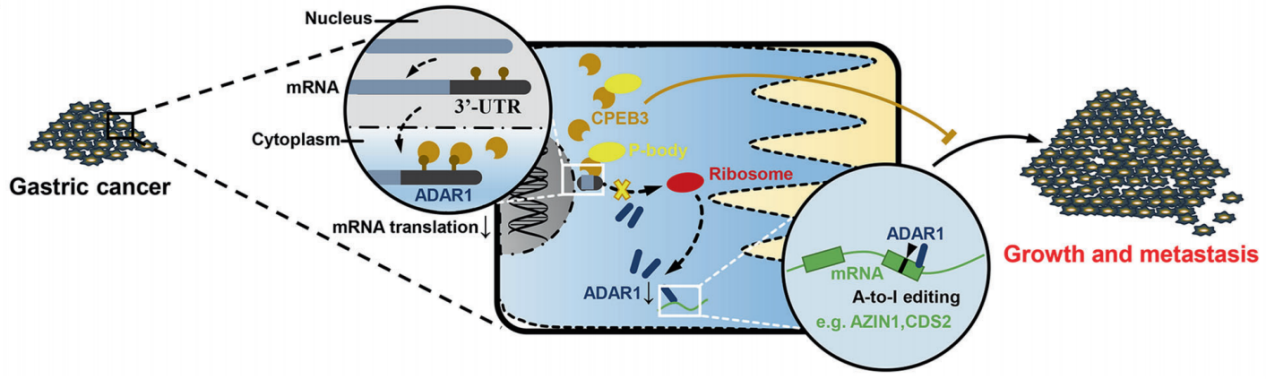
CPEB3通过将ADAR1 mRNA定位到P小体上抑制ADAR1介导的RNA编辑,从而抑制胃癌进展的分子机制示意图

